Gliome
Gliome sind primäre Tumoren des zentralen Nervennervensystems. Sie kommen vor allem im Gehirn, selten aber auch im Rückenmark vor. Die meisten Gliome wachsen infiltrierend.
Einteilung
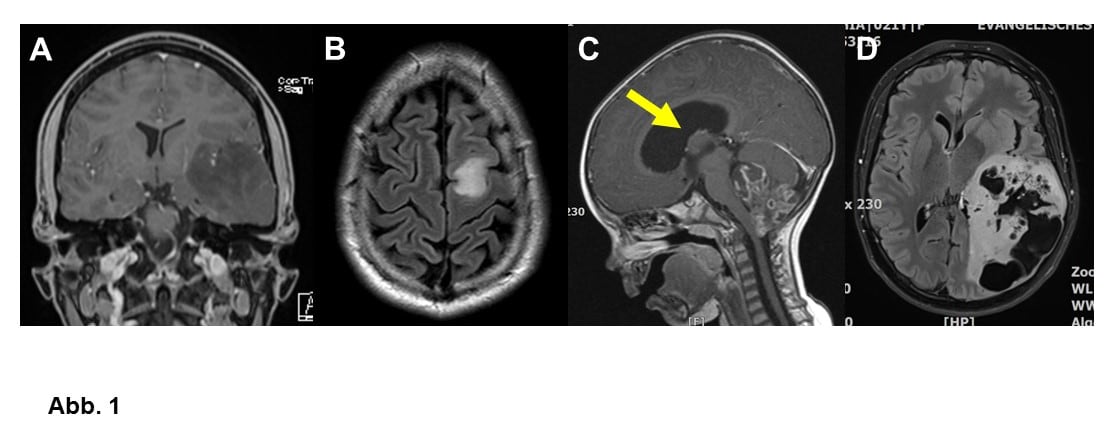
Die Ursprungszellen der Gliome sind die Stützzellen des zentralen Nervensystems, d. h. die Gliazellen. Je nach vermuteter Ursprungszelle (Astrozyt oder Oligodendrozyt) unterscheidet man zwischen Astrozytomen und Oligodendrogliomen (Abb. 1A und B). Manchmal rechnet man auch die Ependymome (Abb. 1C) zu den Gliomen, Ependymome entstehen aus den Zellen, die Hirnkammern auskleiden (Ependym). Es gibt sogenannte glioneuronale Tumoren, die von Zellen abstammen, aus denen noch sowohl Gliazellen als auch Nervenzellen (Neurone) werden können (Abb. 1D).
Gliome werden aber nicht nur nach ihren mutmaßlichen Ursprungszellen, sondern auch nach Wachstumgeschwindigkeit bzw. Bösartigkeit eingeteilt. Man unterscheidet hier die WHO-Grade I (gutartig) bis IV (sehr schnell wachsend, bösartig; Abb. 1-4). Die Verwendung von WHO-Graden erlaubt auch, dass häufige Phänomen der Entartung (maligne Progression) zu beschreiben. Viele Astrozytome und Oligodendrogliome WHO Grad II und III können sich Verlauf in bösartigere WHO Grad III bzw. Grad IV-Tumore (Glioblastome) umwandeln. Häufiger sind allerdings primäre (direkt entstandene) Glioblastome (Abb. 2-4).
Heute werden bei der Einteilung von Gliomen auch molekulare Veränderungen berücksichtigt. Besondere Bedeutung hat dabei der Nachweis von Mutationen (genetischen Veränderungen) des IDH1-Gens, der z.T. ganz einfach mit einer Immunfärbung an einem Gewebeschnitt gelingt. Für die Diagnose eines Oligodendroglioms muß die Neuropathologie den Verlust von Erbsubstanz der Chromosomen 1 und 19 nachweisen (LOH 1p/19q oder Kodeletion 1p/19q). Weitere für die Diagnose wichtige molekulare Veränderungen betreffen u.a. die Gene BRAF, TERT, ATRX und H3F3A. Die sogenannte Promotermethylierung des MGMT-Gens spielt bei der Entscheidung für oder gegen eine Chemotherapie beim Glioblastom eine Rolle.
Entstehung. Sind Gliome vererbbar?
Viele dieser genannten Genmutationen haben etwas mit Gliomwachstum zu tun. Welche molekularen Veränderungen in Gliomen auftreten, ist insgesamt ausführlich untersucht worden. Die Ursachen für diese Mutationen sind aber weitgehend unbekannt geblieben. Strahlenbelastung gilt als Risikofaktor.
Gliome treten im Rahmen verschiedener, seltener Erbkrankheiten auf (z.B. Neurofibromatose Typ 1). Das betrifft aber nur sehr wenige Patienten. Man hat darüber hinaus auch weitere genetische Risikofaktoren identifizieren können. Deren Einfluss ist aber sehr schwach, so dass das bislang keine praktische Bedeutung hat. Entsprechend gilt für nahezu alle Patienten, dass sie ihre Erkrankung nicht an ihre Kinder vererben.
Symptome und Diagnostik
Gliome fallen nicht selten durch epileptische Anfälle auf, je nach Tumorsorte betrifft das zwischen 20 und >90% aller Patienten (Abb. 1A und B). Große und schnell wachsende Tumoren fallen manchmal durch neurologische Symptome wie Sprachstörung oder Halbseitenlähmung auf. Manchmal verlegt Tumorwachstum auch die Hirnwasserabflusswege, so dass sich ein Hydrocephalus ausbildet (Abb. 1C). Der Patient wird müde und kann im Extremfall sogar das Bewusstsein verlieren und versterben. Viele Gliompatienten haben Kopfschmerzen, aber meist ist der Tumor gar nicht die Ursache. Langsam wachsende Tumoren können auch einmal ganz unerwartet anhand eines CCTs (Computertomogramms) oder MRTs (Magnetresonanztomogramms) diagnostiziert werden, dass aus ganz anderen Gründen veranlasst worden ist.
Gliome müssen in aller Regel mittels MRT untersucht werden. Manchmal sind zur Planung einer (chirurgischen) Therapie, einer Biopsie oder zur Verlaufsbeobachtung (s.u.) weitere Untersuchungen sinnvoll wie Perfusions-MRT (Abb. 3), SPECT (single photon/ Einzelphoton-Emissions-Computertomographie) oder Aminosäure-PET (Positronen-Emissions-Tomo-graphie). Eine Angiographie (Gefäßdarstellung) ist nur ganz selten erforderlich.
Chirurgische Therapie
Gliompatienten profitieren ganz eindeutig von einer präzisen neuropathologischen Diagnose, so dass bei nahezu jedem Patienten mindestens eine Gewebsentnahme (Biopsie) erforderlich ist. Oberflächlich gelegene Tumoren können über ein Bohrloch oder einen kleinen Knochendeckel biopsiert werden, zum Auffinden der richtigen Stelle nutzt man die Neuronavigation. V.a. tief gelegene Tumoren werden mit feinen Nadeln stereotaktisch biopsiert (Abb. 4), wozu zumeist zuvor am Schädel ein Rahmen angebracht werden muss. In manchen Kliniken werden hierzu Roboter eingesetzt.
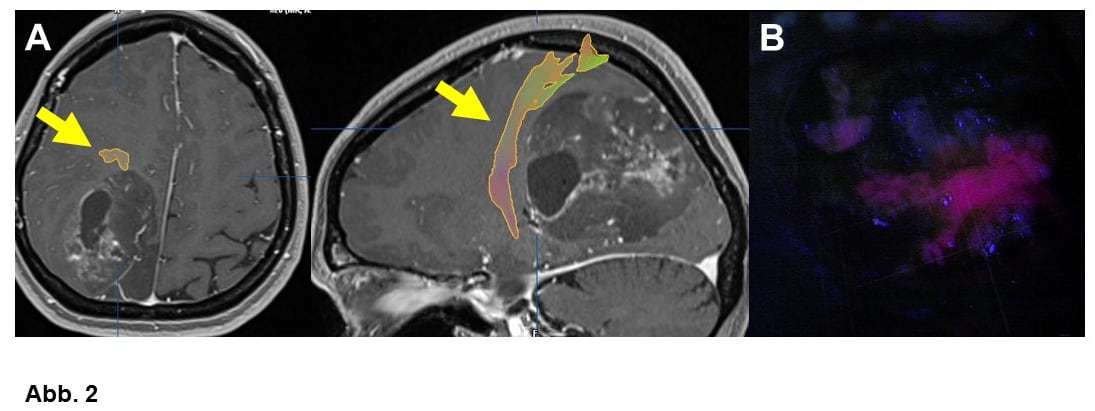
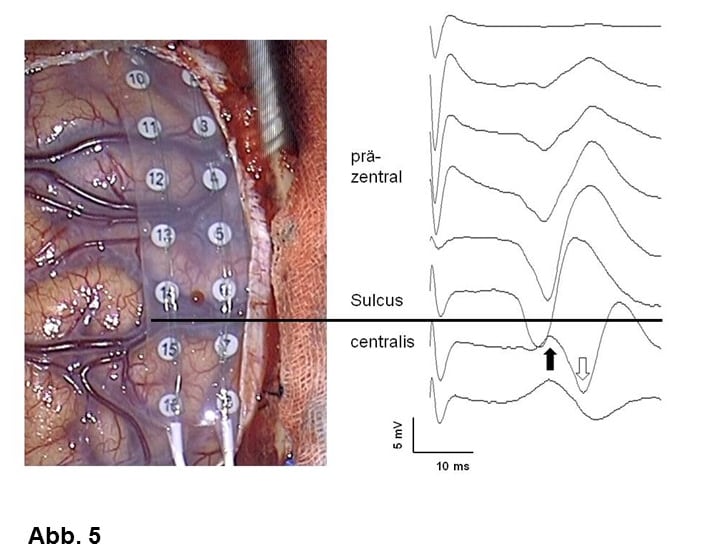
Für nahezu alle Gliome konnte nachgewiesen werden, dass eine Entfernung von Tumorgewebe die Tumorkontrolle verbessert. Daher muss im jeden Fall geprüft werden, ob über eine Gewebsentnahme hinaus nicht auch eine eigentliche Tumorentfernung (Resektion) möglich ist. Um bei einer Tumoroperation wichtige Hirnfunktionen zu schonen, werden vielfältige, zumeist elektrophysiologische (intraoperatives Monitoring, Abb. 5) und manchmal auch bildgebende Techniken (Faserbahndarstellung, Abb. 2A). im Operationssaal eingesetzt. V.a. wenn es um den Erhalt der Sprache geht, wird man ausgewählte Patienten wach operieren wollen (Wach-Operation). Auch bei Tumorresektionen wird die Neuronavigation häufig verwendet. V.a. Glioblastome können mit einem Fluoreszenzfarbstoff angefärbt werden, was ihre Abgrenzung bei der Operation erleichtert (Fluoreszenz-gestützte Resektion, ALA, Abb. 2B).
Nicht operabel ist ein Gliom immer dann, wenn das Risiko für eine Hirnfunktionsstörung durch die Operation die Chance auf verbesserte Tumorkontrolle überwiegt. Man wird auch dann nicht operieren, wenn man nur wenig Tumor sicher entfernen kann, so dass dadurch die Krankheit nicht positiv beeinflusst wird. Wenn ein Gliom gleichzeitig an mehreren Stellen im Gehirn auftritt oder in beiden Hirnhälften wächst, hilft eine Operation in der Regel auch nicht.
Strahlen- und Chemotherapie
Die Strahlen- und die Chemotherapie wird bei immer mehr Gliomen eingesetzt. Es hat sich insbesondere gezeigt, dass vor allem die Kombination aus Strahlen- und Chemotherapie wirksam ist. Verschrieben wird eine sog. fraktionierte Strahlentherapie, bei der der Patient über mehrere Wochen täglich bestrahlt wird. Typischerweise wird dabei die Höhle nach einer Tumoroperation mit einem umgebenden Sicherheitssaum bestrahlt. In der Chemotherapie wird häufig das Medikament Temozolomid eingesetzt, manchmal sogar zusammen mit Lomustin/CCNU, häufig auch eine Kombination aus Procarbazin, Lomustin und manchmal Vincristin (PCV). Bei besonderen Tumorarten oder wenn im Krankheitsverlauf die genannten Behandlungen nicht mehr wirken, kommen auch andere Medikamente zum Einsatz. Wenn seit einer Bestrahlung viele Jahre vergangen sind, oder wenn das zu bestrahlende Volumen sehr klein ist, kann man auch mehr als einmal bestrahlen.
Als Faustregel kann gelten, dass ein WHO-Grad I-Tumor in der nur Regel operiert wird. Bei WHO Grad II-Tumoren wird man vor allem bei Tumorrest zusätzlich strahlen- und chemotherapieren. WHO-Grad III- und IV-Tumoren werden strahlen- und chemotherapiert. Bei älteren Patienten mit einem Glioblastom WHO Grad IV hat sich eine verkürzte Strahlentherapie bewährt. In solchen Fällen kann bei nicht besonders chemosensiblen Tumoren (s.o., keine/wenig MGMT-Promoter-Methylierung) auch der Verzicht auf eine Chemotherapie überlegt werden.
Sonstige Behandlungen
Kleine und umschriebene niedriggradige Gliome (WHO Grad I und II), deren Entfernung sehr gefährlich ist, können interstitiell bestrahlt werden. Hierzu wird wie bei einer stereotaktischen Biopsie (s.o.) eine Strahlenquelle in den Tumor implantiert (interstitielle Radiochirurgie). Diese Therapie wird aber nur in einigen Zentren durchgeführt. Neuartige und experimentelle Therapien werden im Rahmen von klinischen Studien an vielen Zentren angeboten. Eine Teilnahme ist freiwillig und ermöglicht gerade in schwierigen Situationen einen sicheren Zugang zu neuartigen Behandlungsmöglichkeiten.
Nachsorge
Gliompatienten werden typischerweise mittels MRT verlaufskontrolliert und an ein neuronkologisch erfahrenes Behandlungsnetzwerk bzw. Zentrum angebunden. Die jeweilige Tumorsorte und der Krankheitsverlauf bestimmen Zeitpunkt und Abstand der Untersuchungen. Bei speziellen Fragestellungen kommen über die Standard-MRT weitere Untersuchungsmethoden wie Perfusions-MRT, SPECT oder PET (s.o.) zum Einsatz.